Warum das wichtig ist: Pandemien historisch einordnen zu können und aus der Corona-Pandemie die richtigen Schlüsse zu ziehen, ist elementar, um auf die nächste Pandemie vorbereitet zu sein. Denn die Wahrscheinlichkeit ist groß, dass eine solche kommen wird.
Infektionskrankheiten sind in der Menschheitsgeschichte nichts Neues, vielmehr begleiten sie uns seit Beginn der Zivilisation. Mit der globalen Vernetzung und Reisetätigkeit der Menschen entwickelten sie sich schließlich zu Pandemien.
Von einer Pandemie spricht man, wenn eine Krankheit in einer Bevölkerung mit hohen Erkrankungszahlen auftritt und sich die Verbreitung nicht auf eine geographische Region begrenzt, sondern weltweit, oft in Verbindung mit schweren Krankheitsverläufen, vorkommt. Das aktuelle Beispiel ist die Corona-Pandemie. Aus diesem und anderen historischen Beispielen müssen wir für die Zukunft lernen – denn Pandemien werden sich nicht vermeiden lassen. Im Gegenteil: Sie werden sogar noch häufiger auftreten. Wie entstehen Pandemien? Und wie können wir ihnen begegnen? Eine historische Einordnung kann helfen, Pandemien als ein Phänomen zu begreifen, die sich ebenso entwickeln wie die Menschheit, die mit ihnen ringt.
Der schwarze Tod
Die wohl bekannteste Pandemie ist die Pest-Pandemie des 15. Jahrhunderts, auch Schwarzer Tod genannt. Sie kostete rund einem Drittel der europäischen Bevölkerung das Leben. Doch die Krankheit selbst ist noch viel älter: Der bislang älteste Nachweis für den Krankheitserreger der Pest ist rund 3.800 Jahre alt.
Während des Cholera-Ausbruchs im Jahr 1854 in London wandte der britische Arzt John Snow zum ersten Mal epidemiologische Methoden an. Damit konnte er den zeitlichen sowie geographischen Rahmen des Ausbruchs nachvollziehen. Er kam zum Schluss, dass Wasser aus den Pumpen der öffentlichen Wasserversorgung die Ursache des Ausbruchs waren. Durch gezielte Maßnahmen (Entfernen des Pumpenhebels) konnte man die Ausbreitung in betroffenen Stadtvierteln eindämmen. Die Quarantäne als Mittel gegen die Ausbreitung der Pandemie ist auch schon sehr lange bekannt: So etwa wurden schon im Mittelalter Schiffe, auf denen die Pest vermutet wurde, für 40 Tage in Quarantäne gehalten und die Passagiere isoliert.
Pest und Cholera haben sich entlang von Handelsrouten verbreitet. In weiterer Folge hat sich die Ausbreitung von Krankheitserregern durch Schifffahrt, Zugverbindungen und den Luftweg entwickelt.
Bevor sich Krankheiten über die Welt verteilen können, springen sie meist von Tieren auf Menschen über. Geschichtlich betrachtet erhöhte sich die Wahrscheinlichkeit für einen solchen Übertritt durch Interaktionen mit Tieren durch Jagd, Handel von Tieren und Tierprodukten. In unserer globalisierten Welt kann also eine Übertragung von Tier auf Mensch in einem abgelegenen Teil der Erde relativ schnell zu einem Problem für uns alle werden. Die Massentierhaltung der industrialisierten Welt und Tierbuschmärkte in Ländern des Globalen Südens sind zwei Aspekte, die das Aufkommen neuer Krankheiten und den Übertritt auf den Menschen wahrscheinlicher machen (Pulliam et al., 2012; Wolfe et al., 2005). Wenn man sich die Häufigkeit von Pandemien am Beispiel Influenza seit dem neunzehnten Jahrhundert ansieht, zeigt sich, dass pro Jahrhundert drei bis vier Pandemien auftreten.
Auch wenn die Corona-Pandemie irgendwann verschwunden sein wird – das Problem von Pandemien wird uns weiterhin beschäftigen. Die Frage, die Wissenschaftler:innen beantworten müssen, ist nicht, ob es zu einer neuen Pandemie kommen wird, sondern wann und wie wir mit ihr umgehen können. Was können wir aus der Corona-Pandemie lernen?

Zur Zeit des Schwarzen Todes trugen Pestärzte oft solche Pestmasken. Geholfen hat es nicht.
Berührung mit Folgen
Virale Epidemien und in der Folge Pandemien treten oft ohne Vorwarnungen auf, was unweigerlich zu Fragen nach ihrer Herkunft führt. Sogenannte Zoonosen oder auch Tierseuchen sind Krankheiten, die von Tier zu Mensch bzw. von Mensch zu Tier übertragen werden. Dabei ist die Übertragung von Pathogenen (Krankheitserreger) meist ein mehrstufiger Prozess, wobei eine Vielzahl von Hürden überwunden werden muss.
Drei Viertel der auftretenden, humanen Pathogene werden von Tieren auf den Menschen übertragen, wobei ein Großteil in wilden Tieren vorkommt (White & Razgour, 2020). Viele Viren, die mehrere Spezies infizieren können, bilden ein sogenanntes Reservoir in einem Wirt. In diesem Wirt führt das Virus normalerweise zu keiner Krankheit oder es treten nur sehr milde Krankheitssymptome auf. Wenn sich ein potenzieller neuer Wirt findet, kann es zu einer Übertragung kommen, die jedoch normalerweise nicht zu weiteren Ansteckungsfällen führt.
Übertragungen, die ursprünglich zwischen Tieren stattfinden, können eines Tages auch uns betreffen. Damit ein Virus von Tier zu Menschen überspringt, müssen einige Konstellationen genau eintreffen. Die Wahrscheinlichkeit, dass es zu einer Übertragung kommt, ist nicht besonders groß – doch noch immer groß genug, damit wir sie ernst nehmen müssen. Man kann sich den Prozess wie Russisches Roulette vorstellen. Durch die Klimakrise drücken wir nun viel öfters den Abzug und verschlechtern damit die Chancen, unbeschadet davonzukommen.
Eine Pandemie wird also meist ausgelöst, wenn ein neuartiger Virus von einem Tier auf einen Menschen überspringt. Die Klimakrise hat dieses Szenario wahrscheinlicher gemacht. Doch welche ihrer Folgen sind es, die Infektionsketten begünstigen? Und was können wir gegen sie tun?
Lebensraum verschwindet: Wenn sich Mensch und Tier näher kommen
Mehr als die Hälfte der globalen Bevölkerung lebt in urbanen Gebieten und es ist davon auszugehen, dass die Bevölkerungsdichte in Städten in naher Zukunft weiter zunehmen wird. Influenza A H1N1, besser bekannt als Schweinegrippe, hat uns gezeigt, wie schnell sich urbane Epidemien in Pandemien entwickeln können. Glücklicherweise hat sich herausgestellt, dass ältere Teile der Bevölkerung eine Kreuzimmunität von der Spanischen Grippe und ähnlichen, bis 1957 zirkulierten Subtypen besitzen und so ihre Immunsysteme nicht auf einen gänzlich neuen Erreger getroffen sind. Durch den rasanten Bevölkerungsanstieg können Großstädte jedoch als Inkubatoren dienen und so neue Pandemien anfachen.
Die fortschreitende Urbanisierung beansprucht auch immer mehr Raum für landwirtschaftliche Produktion oder neuen Wohnraum. Das führt dazu, dass Tiere, die Träger von Pathogenen sein können, Lebensraum verlieren und so unweigerlich neue Übertragungsmöglichkeiten auf den Menschen entstehen.
Wie kann man sich nun konkret neue Übertragungsmöglichkeiten vorstellen? Ein warnendes Beispiel ist die Übertragung des Nipah-Virus. Hier spielten gleich mehrere Faktoren eine Rolle. Man geht davon aus, dass das Nipah-Virus 1999 in Malaysia auf einer Schweinefarm, in deren Nähe Fledermäuse ansässig waren, zunächst von Fledermäusen auf Schweine übertragen wurde. Daraufhin infizierten sich Schweinebauern mit dem Virus. Man muss sich eine Übertragung mitunter jedoch gar nicht exotisch oder in komplexen Kaskaden vorstellen. Ein Streichelzoo, offene Tiermärkte, Rummelplätze oder Zoos können den notwendigen Kontakt zwischen Mensch und Tier herstellen, um einem Virus zu erlauben, auf die jeweils andere Spezies überzuspringen (Pulliam et al., 2012).
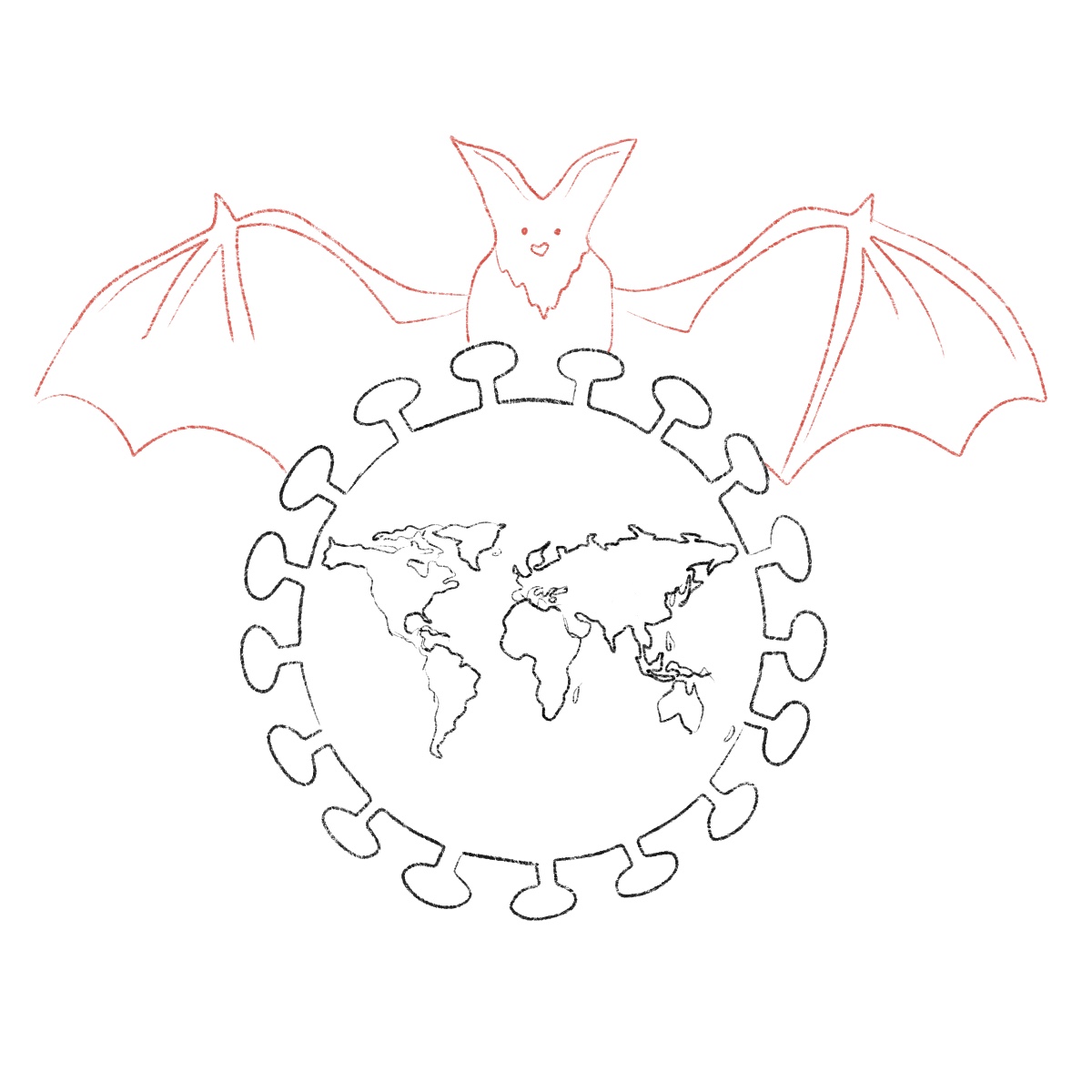
Oftmals sind Fledermäuse Träger von Pathogenen, die auf den Menschen überspringen. Je stärker der Mensch den Lebensraum der Tiere beschneidet, desto größer die Chance einer neuen Übertragung.
Wenn Tiere wandern müssen
Durch die Klimakrise kommt es auch zu geographischen Neuerschließungen von Krankheitserregern. Es gibt Belege dafür, dass sie die geographische Ausbreitung von Malaria in Wildvögeln vorantreibt. Da Wildtiere, im Besonderen Wildvogelarten, praktisch keinen Schutz vor klimatischen Veränderungen besitzen, gelten diese als gute Indikatoren für Effekte des Klimawandels auf die Tierwelt (Garamszegi, 2011).
Glücklicherweise ist ein großer Ausbruch von Malaria in Europa unwahrscheinlich, selbst wenn sich die klimatischen Bedingungen dahingehend verändern, dass Moskitos auch bei uns heimisch werden. Unser Gesundheitssystem ist auf dieses Szenario vorbereitet und kann Anti-Malaria-Medikamente zur Verfügung stellen.
Wie sehr Klima und Infektionskrankheiten zusammenhängen, zeigt ein Blick auf Studien, die sich mit dem Klimaphänomen El Niño und daraus resultierenden epidemischen Ausbreitungen von Krankheiten wie beispielweise Dengue-Fieber, Malaria und Cholera in Südamerika und Indien beschäftigen. El Niño ist eine nicht zyklisch auftretende Meeresströmung. Im Jahr 2015 brachte El Niño die perfekten Bedingungen zur Ausbreitung von Zika-Viren in Südamerika, da sich das Verbreitungsgebiet der Aedes-Mücken bei höheren Temperaturen vergrößert und weibliche Mücken häufiger stechen (Paz & Semenza, 2016).
In einer druckfrischen Studie beschreibt ein Team der Universität Georgetown um Biologe Colin Carlson eine Simulation bei der sie die Reichweite von 3.100 Säugetierarten in der Vergangenheit, Gegenwart und Zukunft überlappten und daraus die Wahrscheinlichkeit für Virus-Übertragung vorhersagen konnten. Die Ergebnisse sind einigermaßen erschreckend. So kommt es selbst unter den optimistischsten Bedingungen zu 300.000 erstmaligen Begegnungen zwischen Tierarten, die normalerweise nicht miteinander interagieren. Dies führt zu ungefähr 15.000 Übertragungen von Viren auf neue Tierarten.
Die Studienautoren nennen ihre Studie „Eisberg“, in Anlehnung an die unsichtbare Gefahr, auf die wir zusteuern. Ihre Simulation hat gezeigt, dass bereits jetzt eine unwiderrufliche Durchmischung von Säugetierviren stattgefunden hat, die selbst dann nicht rückgängig gemacht werden kann, wenn wir morgen aufhören, C0₂-Emissionen auszustoßen. Viele Übertragungen werden in Bergregionen in Südostasien und Afrika stattfinden, da wärmere Temperaturen Tiere in höhere und vor allem kühlere Bereich drängt. In Südostasien sind zahlreiche Fledermausarten beheimatet, die Träger einer Vielzahl von diversen Viren sind und deren Gebiete sich auch weitgehend überlappen.
In Afrika sind Fledermäuse sehr wahrscheinlich das natürliche Reservoir für Ebola. 13 Fledermausarten können das Virus in sich tragen. Der Klimawandel zwingt sie dazu, sich zu verteilen. Laut Prognosen wird dieser Prozess zu Begegnungen mit 3.700 neuen Säugetierarten und zu fast 100 Übertragungen führen. Die größten Ebola-Ausbrüche fanden bislang in Westafrika statt, doch die Krankheit könnte aufgrund der Ausbreitung von Fledermausarten durch den Klimawandel innerhalb von Jahrzenten auch für Ostafrika problematisch werden (Carlson et al., 2022).
Klimatische Extremereignisse wie Waldbrände, Überschwemmungen oder Dürren können ebenso kurzfristig dazu führen, dass es zu weiteren Ausbreitungen von Infektionskrankheiten kommt. Beispielweise dürfte eine extreme Überschwemmung Anfang des 20. Jahrhundert und ein darauffolgender Kälteeinbruch dazu beigetragen haben, dass es zu einer neuerlichen Cholera-Pandemie kam (Krishnamurthy & Goswami, 2000). Ein weiteres Beispiel ist die Übertragung von Gelbfieber auf Affen im brasilianisch-atlantischen Regenwald im Jahr 2016. Wobei Tierseuchen durch klimatische Anomalien oftmals menschlichen Fällen voraus sind, so wie auch im Fall der Gelbfieber-Epidemie 2017/2018 in Brasilien (Cunha et al., 2020).
Welche Viren könnten eine neue Pandemie auslösen?
Die Weltgesundheitsorganisation (WHO) gibt in ihrer Prioritätenliste aus dem Jahr 2015 einige Infektionserkrankungen an, die für das öffentliche Gesundheitswesen die größte Gefahr darstellen, da es keine Impfstoffe oder nur unzureichend Medikamente zur Behandlung gibt. Die Liste beinhaltet derzeit (Stand Mai 2022) u.a. COVID-19, das Krim-Kongo-Fieber, das Ebolafieber, das Marburgfieber, das Lassa-Fieber, Middle East respiratory syndrome coronavirus (MERS-CoV), Severe Acute Respiratory Syndrome (SARS), das Rifttalfieber oder das Zika-Fieber.
Geht es jedoch darum, welches Virus am wahrscheinlichsten eine neue Pandemie hervorrufen kann, sind Influenza-Viren ganz vorne anzusiedeln. Wenn ein neuer Typ verschieden genug von allen bekannten Stämmen ist, kann es dazu kommen, dass noch keinerlei Immunität in der Bevölkerung vorhanden ist und dadurch eine potenzielle Pandemie ausgelöst werden kann. Zu solch einem Ereignis ist es beispielsweise 2009 bei der Schweinegrippe gekommen.
Die jährlichen Influenza-Wellen in der Bevölkerung werden vor allem durch Mutationen in den Oberflächenproteinen Hämagglutinin HA und Neuraminidase NA ausgelöst. Eine typische Influenza-Saison verursacht weltweit ungefähr 5 Million schwere Krankheitsfälle und etwa 500.000 Todesfälle (Roguski et al., 2019).
Was haben wir gelernt?
Wie bereiten wir uns nach Corona auf die nächste Pandemie vor? Um für die nächste Pandemie gewappnet zu sein, wurde die sogenannte Coalition for Epidemic Prepardeness Innovations (CEPI) 2017 in Davos gegründet. Ihr Ziel ist es, im Falle einer nächsten Pandemie innerhalb von 100 Tagen einen Impfstoff bereitzustellen. Wie man anhand der COVID-19 Pandemie sieht, sind auch wirtschaftliche Einbußen mit Pandemien verbunden. So kostete die Pandemie bislang schätzungsweise 4,1 Billionen US-Dollar oder fast 5 Prozent des globalen Bruttoinlandprodukts.
Vor der COVID-19-Pandemie dauerte es bis zu 10 Jahre, um einen Impfstoff zu entwickeln. Durch die neue mRNA-Technologie ist es gelungen, innerhalb von 326 Tagen einen sicheren und effektiven Impfstoff zu entwickeln. Wäre es uns gelungen, den Impfstoff innerhalb von 100 Tagen bereit zu stellen, hätten Millionen von Leben gerettet und Milliarden von wirtschaftlichen Schäden abgewendet werden können.
Genau dieses Ziel soll nun für die nächste Pandemie erreicht werden, um so der Welt eine Chance zu geben, den Ausbruch einzudämmen, bevor es zu einer globalen Krise kommt. Für dieses Ziel stehen 3,5 Milliarden Dollar bereit, die auch dazu genutzt werden sollen, ein internationales Viren-Überwachungssystem aufzubauen oder um Prototyp-Bibliotheken für Impfstoffe voranzutreiben. Die Implementierung von Überwachungsprogrammen zur schnellen Detektion von Pathogenen, die von Tieren auf den Menschen übertragen werden, sind von fundamentaler Bedeutung. Dies gilt besonders für abgelegenere Regionen in Afrika, Asien und Südamerika.
Ein weiterer Ansatz ist es, vermehrt in die ökologische Grundlagenforschung zu investieren, um nach exotischen Virenreservoirs Ausschau zu halten.
Pandemien: Symptom unseres Lebenswandels?
Pandemien hängen – so wie die Klimakrise – eng mit unserer modernen Lebensweise zusammen. Denken wir also darüber nach, wie wir Pandemien in Zukunft verhindern können, müssen wir auch über das Leben reflektieren, das wir führen. Wir sollten uns etwa die Frage stellen, ob wir unbedingt industrielle Schweine- und Geflügelfarmen in dem Ausmaß brauchen, wie sie gegenwärtig vorkommen. Wir sollten uns ebenfalls darüber Gedanken machen, wie die Bevölkerung informiert und aufgeklärt werden kann. Die Kommunikation wissenschaftlicher Fakten spielt als Vorbereitung auf eine neue Pandemie eine wichtige Rolle. Konventionelle wie soziale Medien sind hierfür zentral.
Mit weiterem Voranschreiten der Klimakatastrophe ist davon auszugehen, dass auch neue Lebensräume für Vektoren wie Moskitos erschlossen werden und diese dann auch bei uns heimisch werden. Das kann dazu führen, dass die Infektionskrankheiten, die sie in sich tragen, auch vermehrt im europäischen Raum auftreten werden.
Drei der größten Bedrohungen unserer Existenz, die Klimakrise, Pandemien und das sechste Massenaussterben, sind eng miteinander verwoben. Wollen wir diesen Problemen begegnen, müssen wir unseren Lebenswandel kritisch hinterfragen. Wir werden die nächste Pandemie nicht verhindern können, aber wir können sehr wohl auf sie vorbereitet sein.
Simon Gerner studierte Biotechnologie an der Universität für Bodenkultur (BOKU) in Wien. Während eines Auslandssemesters in Schweden tauchte er erstmals in die Welt der Viren ein. Seitdem ist er von ihnen fasziniert.
Derzeit ist er in der Forschung und Entwicklung von Impfstoffen tätig. In letzter Zeit fragte er sich: Was passiert eigentlich nach der Corona-Pandemie? Wie wahrscheinlich ist es, dass in unserer Lebenszeit eine weitere, vielleicht noch gefährlichere Pandemie auftaucht?
Hier findest du Simon auf LinkedIn.
Carlson, C.J., Albery, G.F., Merow, C. et al. (2022). Climate change increases cross-species
viral transmission risk. Nature. https://doi.org/10.1038/s41586-022-04788-w
Carlson CJ, Zipfel CM, Garnier R, Bansal S. (2019). Global estimates of mammalian viral
diversity accounting for host sharing. Nat Ecol Evol. 3(7):1070-1075.
doi:10.1038/s41559-019-0910-6.
Caminade, C., McIntyre, K. M., & Jones, A. E. (2019). Impact of recent and future climate
change on vector-borne diseases. Annals of the New York Academy of Sciences, 1436(1),
157–173. https://doi.org/10.1111/nyas.13950
Cunha, M. S., Tubaki, R. M., de Menezes, R. M. T., Pereira, M., Caleiro, G. S., Coelho, E.,
Saad, L. del C., Fernandes, N. C. C. de A., Guerra, J. M., Nogueira, J. S., Summa, J. L.,
Coimbra, A. A. C., Zwarg, T., Witkin, S. S., Mucci, L. F., Timenetsky, M. do C. S. T.,
Sabino, E. C., & de Deus, J. T. (2020). Possible non-sylvatic transmission of yellow fever
between non-human primates in São Paulo city, Brazil, 2017–2018. Scientific Reports,
10(1), 1–8. https://doi.org/10.1038/s41598-020-72794-x
Garamszegi, L.Z. (2011), Climate change increases the risk of malaria in birds. Global
Change Biology, 17: 1751-1759. https://doi.org/10.1111/j.1365-2486.2010.02346.x
Lindh, E., Argentini, C., Remoli, M. E., Fortuna, C., Faggioni, G., Benedetti, E.,
Amendola, A., Marsili, G., Lista, F., Rezza, G., & Venturi, G. (2019). The Italian 2017
outbreak chikungunya virus belongs to an emerging aedes albopictus-adapted virus
cluster introduced from the Indian subcontinent. Open Forum Infectious Diseases, 6(1).
https://doi.org/10.1093/ofid/ofy321
Morse, S. S., Mazet, J. A. K., Woolhouse, M., Parrish, C. R., Carroll, D., Karesh, W. B.,
Zambrana-Torrelio, C., Lipkin, W. I., & Daszak, P. (2012). Prediction and prevention of
the next pandemic zoonosis. The Lancet, 380(9857), 1956–1965. https://doi.or
/10.1016/S0140-6736(12)61684-5
Paz & Semenza (2016) El Niño and climate change—contributing factors in the dispersal
of Zika virus in the Americas? The Lancet, 387(10020), 745
Pulliam, J. R. C., Epstein, J. H., Dushoff, J., Rahman, S. A., Bunning, M., Jamaluddin, A.
A., Hyatt, A. D., Field, H. E., Dobson, A. P., & Daszak, P. (2012). Agricultural
intensification, priming for persistence and the emergence of Nipah virus: A lethal bat
borne zoonosis. Journal of the Royal Society Interface, 9(66), 89–101.
https://doi.or/10.1098/rsif.2011.0223
Roguski, K. M., Chang, H. H., Palekar, R., Tempia, S., Cohen, C., Gran, M., Schanzer, D.,
Cowling, P. B. J., Wu, P., Kyncl, J., Ang, L. W., Park, M., Redlberger-fritz, M.,
Espenhain, L., Krishnan, P. A., Emukule, G., Asten, L. Van, Aungkulanon, S.,
Widdowson, M., … Disease, I. (2019). Estimates of global seasonal influenza-associated
respiratory mortality: a modelling study. The Lancet, 391(10127), 1285–1300.
https://doi.org/10.1016/S0140-6736(17)33293-2.Estimates
White, R. J., & Razgour, O. (2020). Emerging zoonotic diseases originating in mammals: a
systematic review of effects of anthropogenic land-use change. Mammal Review, 50(4),
336–352. https://doi.org/10.1111/mam.12201
Widdowson, M. A., Bresee, J. S., & Jernigan, D. B. (2017). The global threat of animal
influenza viruses of zoonotic concern: Then and now. Journal of Infectious Diseases,
216(Suppl 4), 493–498. https://doi.org/10.1093/infdis/jix331
Wolfe, N. D., Daszak, P., Kilpatrick, A. M., & Burke, D. S. (2005). Bushmeat hunting,
deforestation, and prediction of zoonotic disease emergence. Emerging Infectious
Diseases, 11(12), 1822–1827. https://doi.org/10.3201/eid1112.040789

.jpg)