Dieser Beitrag erschien im Zuge des alexandria-Themenschwerpunkts "Zukunft". Den ganzen April fragen wir uns: Was wird uns in der Zukunft erwarten - und welchen Beitrag kann die Wissenschaft dazu leisten?
Warum das wichtig ist: Oft kann man etwas erst glauben, wenn man es selbst gesehen hat. Doch in der Molekularbiologie ist das nicht so einfach. Kleinste Strukturen, die nur wenige Nanometer groß sind, wurden erst mithilfe der Elektronenmikroskopie für das menschliche Auge sichtbar. Ein neuer Weltrekord in der Auflösung verspricht Entdeckungen, die Lehrbücher verändern werden und die auch in der Industrie das Interesse an dieser Technologie wecken konnten.
Ich habe mich schon oft gefragt: Wie können wir etwas Biologisches – wie ein Bakterium, ein Virus oder ein Protein – sehen, das eine Million Mal kleiner ist als der Bildschirm des Laptops, auf dem ich gerade schreibe?
Wenn ihr hier klickt, kommt ihr zu dem Bild eines Artikels aus der Fachzeitschrift Nature. Das runde Knäuel aus vielen verschiedenen Aminosäuren ist das Protein Apoferritin. Es ist in unserem Körper für die Eisenaufnahme über die Darmschleimhaut verantwortlich. Für unser bloßes Auge ist das Protein unsichtbar. Wir können nur Objekte erkennen, die zumindest 0,2 Millimeter groß sind. So groß ist zum Beispiel ein Floh.
Apoferritin hat einen Durchmesser von nur 12 Nanometern – das sind 0,000012 Millimeter. Ein Nanometer ist im Vergleich zu einem Fußball so groß wie der Fußball im Vergleich zum Planeten Erde. Ein Nanomenter ist ein Milliardstel Meter. Damit ist Apoferritin sehr viel kleiner als ein Floh.
Mit einem Lichtmikroskop, wie ihr es vielleicht aus dem Biologieunterricht kennt, könnten wir Apoferritin nicht sehen. Doch die Mikroskopie hat sich, so wie andere Bereiche der Forschung, entwickelt und immer wieder neue Methoden erfunden, um die Dinge dieser Welt sichtbar zu machen. Die Fortschritte in der Mikroskopie in den letzten fünfzehn Jahren waren groß, Expert:innen sprechen sogar von einer Revolution: von der sogenannten Auflösungsrevolution. Innerhalb weniger Jahre konnte man die Auflösung so stark verbessern, dass man jetzt dabei ist, die Grenze von 1 Ångström (0,1 Nanometer) für biologische Proben zu knacken. Das bedeutet, wir können einzelne Atome sehen. Und das wiederum ermöglicht einen Blick in eine Welt voller neuer Erkenntnisse, die uns bisher verborgen blieben.
Für diesen Werkstattbericht sprach ich mit zwei Experten, dem Molekularbiologen David Haselbach und dem Mikroskopisten Thomas Heuser, über die Gegenwart und Zukunft der Elektronenmikroskopie. Haselbach leitet seine eigene Forschungsgruppe am Institut für Molekulare Pathologie (IMP), die mithilfe von Kryo-Elektronenmikroskopen molekulare Prozesse verstehen will. Heuser leitet seit acht Jahren die Serviceeinrichtung Elektronenmikroskopie, nachdem er zuvor in Deutschland, den USA und Kanada studiert und geforscht hat.
Beide arbeiten am Vienna BioCenter, eines von Europas größten Zentren für Lebenswissenschaften. Es vereint Forschung, Bildung und Unternehmen und liegt in St. Marx, im dritten Wiener Gemeindebezirk. Am Ende meines Besuches konnte ich das Elektronenmikroskop bei der Arbeit sehen. Mit Thomas Heuser fertigte ich ein Foto des eingangs erwähnten Proteins Apoferritin an. Wie sieht etwas aus, das so unglaublich klein ist?
Vom Licht zu Elektronen
In der Anfangszeit der Mikroskopie wurde nur Licht verwendet, um winzige Objekte abzubilden, die mit dem freien Auge nicht mehr zu sehen waren. Ein Lichtmikroskop kann zum Beispiel Zellen von Tieren, Pilzen und Pflanzen sowie viele Bakterien abbilden. Es wird dafür auch noch heute verwendet. Doch um Dinge abzubilden, die noch kleiner sind als Zellen und Bakterien – also kleiner sind als 500 Nanometer – musste eine neue Technologie erfunden werden: die Elektronenmikroskopie.
Lange Zeit konnte nur tote Materie abgebildet werden. Das änderte sich mit der Entwicklung der Kryo-Elektronenmikroskopie. Kryo bedeutet Frost. Mit dieser Methode konnten endlich auch biologische Proben in ihrem nativen Zustand, also in ihrem natürlichen Zustand und in ihrer natürlichen Umgebung, gesehen und abgebildet werden. Noch viel besser: Man war endlich in der Lage, auch biologische Prozesse, also Abläufe über einen bestimmten Zeitraum, abzubilden. Zum Beispiel kann man den Prozess der Translation – also das Umschreiben der mRNA in Proteine, was in den Ribosomen geschieht – beobachten. Das ist ein elementarer Prozess von Lebewesen, denn die mRNA enthält die Information der DNA. Um so einen Prozess abbilden zu können, wird die Probe mit Zellen, die die Ribosomen enthalten, zu unterschiedlichen Zeitpunkten schockgefroren, dünn aufgeschnitten, die Schnitte im Elektronenmikroskop abgelichtet und diese dann mit Unterstützung einer Software am Computer zu einem 3D-Bild zusammengefügt.
Bisher war die Elektronenmikroskopie eine akademische Disziplin. Doch seitdem die (nahezu) atomare Auflösung bei biologischen Proben möglich ist – also einzelne Atome sichtbar werden – wird diese Technologie auch für die Industrie interessant. Und dort ist meist genügend Geld vorhanden, um in neue Technologien zu investieren und sie weiterzuentwickeln. „Einige Millionen Euro hat unser neues Elektronenmikroskop gekostet“, erzählt David Haselbach. Der Raum, in dem das Mikroskop steht, musste um zusätzlich 500.000 Euro umgebaut werden.
So viel Geld in ein neues Gerät zu investieren, spricht dafür, dass die Elektronenmikroskopie auch in Zukunft sehr wichtig sein wird. „Vor allem die Kryo-Elektronentomographie, eine Art der Elektronenmikroskopie, ermöglicht das erste Mal ein realistisches Bild von nativen Zellen, Viren und Proteinen zu bekommen“, so Haselbach. In den meisten Lehrbüchern ist der Aufbau einer Zelle so dargestellt: die Zellmembran und/oder -wand umschließt die Erbinformation (bei manchen Lebewesen im Zellkern) und ein paar Organellen. In Wirklichkeit aber ist die Zelle sehr dicht gepackt. Die gemalten Bilder des US-Künstlers David Goodsell kommen der Realität schon sehr nahe. Solche Darstellungen werden erst in Zukunft mit den neuesten Elektronenmikroskopen möglich sein.
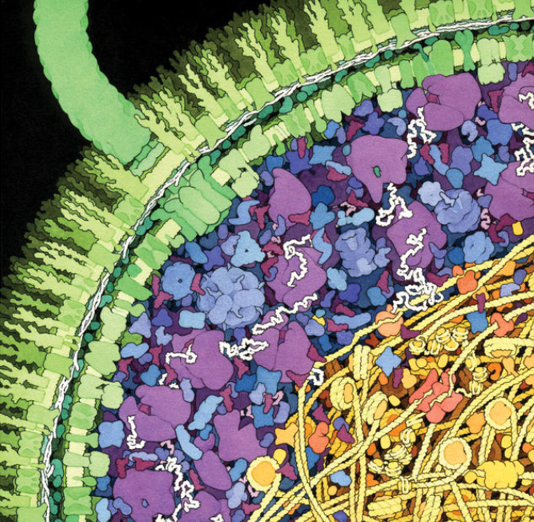
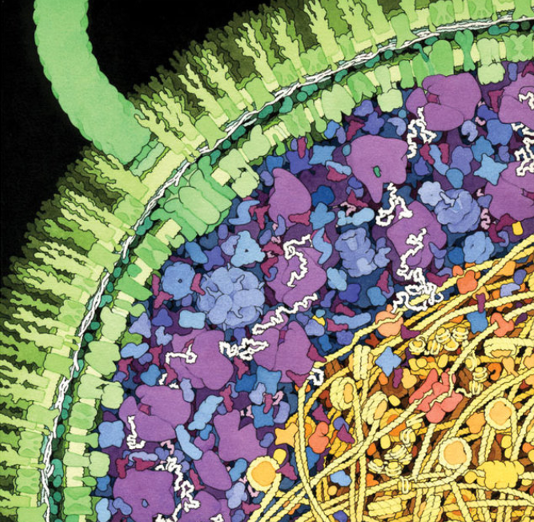
Ein Querschnitt durch das Bakterium Escherichia coli (E. coli) als Aquarell von David Goodsell. Auf seinem Twitter-Account sind die einzelnen Komponenten der Zelle beschriftet. Mit der modernen Elektronenmikroskopie (Kryo-Elektronentomographie) können erstmals annähernd so realistische Aufnahmen gemacht werden.
© RCSB Protein Data Bank
Was machen die Elektronen im Mikroskop?
In der Elektronenmikroskopie entstehen Bilder einer Probe, indem diese mit Elektronen beschossen wird. Elektronen werden in der Elektronenkanone des Mikroskops erzeugt. Die elektromagnetischen Linsen bündeln diese Elektronen zu einem präzisen Strahl. Ein Vakuum im Mikroskop verhindert, dass die Elektronen mit Gasmolekülen der Luft zusammenstoßen. So können sie ungehindert auf die Probe treffen.

Elektromagnetische Linsen sind ein wichtiger Bestandteil des Elektronenmikroskops. Sie bündeln die Elektronen, um einen feinen Elektronenstrahl, der auf die Probe gerichtet wird, zu erzeugen.
Foto: Verena Steinwider
Elektronen sind für unser bloßes Auge unsichtbar. Ein Detektor aber kann aus ihnen ein Bild erzeugen. Lange Zeit wurden dafür Szintillatoren verwendet. Sie können Elektronen in Photonen umwandeln. Photonen können von einem Sensor gesammelt und so Pixel für Pixel zu einem Bild zusammengesetzt werden. Heute wird ein direkter Elektronendetektor verwendet, der keinen Szintillator zwischengeschaltet braucht.
So kommt man also zu einem Bild von einem sehr kleinen Objekt. Wie gut das Bild ist, hängt von seiner Auflösung ab.
Ångström und Auflösung – ein neuer Weltrekord in Reichweite
Eine Auflösung von 1 Ångström (0,1 Nanometer) bedeutet, dass zwei Strukturen, die 0,1 Nanometer voneinander entfernt sind, als getrennte Strukturen wahrgenommen werden können. Heißt also, je kleiner die Auflösung, desto kleinere Strukturen kann man identifizieren. Statt einen Wald zu sehen, erlaubt uns diese Auflösung also, die einzelnen Bäume voneinander unterscheiden zu können.
Lange galt eine Auflösung von 1 Ångström für biologische Proben als unmöglich. Bisher lag der Weltrekord bei 1,25 Ångström. Damit konnte man einzelne Atome einer Proteinstruktur beobachten.
Als ich das BioCenter besuchte, ging ich noch davon aus, dass der Weltrekord der Auflösung für biologische Proben nach wir vor 1,25 Ångström betrug. Doch David Haselbach überraschte mich: „Wir sind mittlerweile bei einer Auflösung von 1 Ångström. Noch ist es nicht publiziert, die Arbeit wurde aber auf einer Konferenz bereits vorgestellt.“ Wow! Es wird also einen neuen Weltrekord geben. Die Ergebnisse, auf die Haselbach anspielt, müssen nur noch durch den Peer-Review-Prozess. Aber wie wurde dieser Weltrekord möglich gemacht? Haselbach erklärt: „Durch längere Datenaufnahme und längeres Rechnen.“
Die Auflösung der Mikroskopie erlebte in den letzten Jahren eine Revolution durch verbesserte Hardware (Kameras und Linsen), verbesserte Probenaufbereitung (Kryo-Elektronenmikroskopie) und bessere Software. „Es hängt aber auch sehr viel von der Qualität der Probe ab“, sagt Thomas Heuser. Das neue, einige Millionen Euro teure Elektronenmikroskop, das bei Heuser in der Serviceeinrichtung steht, sollte theoretisch in der Lage sein, ebenfalls Bilder in einer Auflösung von 1 Ångström zu machen.
Ab ins Labor!
Nach meinem Gespräch mit den beiden Experten David Haselbach und Thomas Heuser, besuchte ich letzteren in seinem Labor, um Fotos von dem kleinen Protein Apoferritin zu machen. Gemeinsam bereiteten wir eine Probe davon vor, um dann das Foto mit einem Elektronenmikroskop aufnehmen zu können.
Da auch die Qualität der Probe die Auflösung eines Bildes zu einem wesentlichen Teil bestimmt, ist die Probenaufbereitung besonders wichtig. Fotografieren wird hier zu einer heiklen Angelegenheit: Die Probe muss vor Dehydrierung und Strahlungsschäden geschützt werden. Die Dehydrierung erfolgt durch das Vakuum, das im Elektronenmikroskop vorhanden ist. Die Strahlungsschäden durch den Beschuss der Probe mit Elektronen.
In der Probenaufbereitung für die Elektronenmikroskopie (EM) unterscheidet man zwischen der klassischen EM und der Kryo-EM. Wir führten beide Methoden durch. Denn jede Methode hat Vor- beziehungsweise Nachteile. Die klassische Methode ist weniger aufwendig und nicht so teuer. Die Bildqualität ist allerdings nicht so gut wie bei der zeitaufwendigen, teureren und neueren Methode: der Kryo-EM.

Foto: Verena Steinwider
Die Klassikerin: die Negativkontrastierung
Unserer Probelösung (Apoferritin) wurde auf ein drei Millimeter kleines Gitter pipettiert. Um Apoferritin für das Elektronenmikroskop sichtbar zu machen, tropften wir eine Schwermetalllösung (Phosphorwolframsäure) auf das Protein. Die sehr schweren Atome der Schwermetalllösung streuen die Elektronen des Mikroskops stärker als leichte Atome und verstärken den Kontrast des Bildes. So ist die Struktur von Apoferritin erkennbar. Diese einfache Methode ermöglicht erste Informationen über Qualität und Struktur der Probe.

Ein einfaches Elektronenmikroskop und dazugehörige Monitore. Die grüne Scheibe im Elektronenmikroskop ist der Szintillator, der die Elektronen in Photonen umwandelt. Die Photonen wurden in unserem Fall mithilfe einer Digitalkamera in ein Foto umgewandelt. Das Foto unserer Apoferritin Probe ist auf dem Monitor erkennbar.
Foto: Verena Steinwider
Die Neue: die Kryo-Elektronenmikroskopie
Ist die Qualität der Probe gut, kann man eine der Kryo-EM-Methoden anwenden, um eine bessere Auflösung des Bildes zu erhalten. Je nach gewünschter Auflösung des Bildes arbeitet ein:e Forscher:in mehrere Stunden oder auch Tage, um ein gutes Bild zu erhalten.
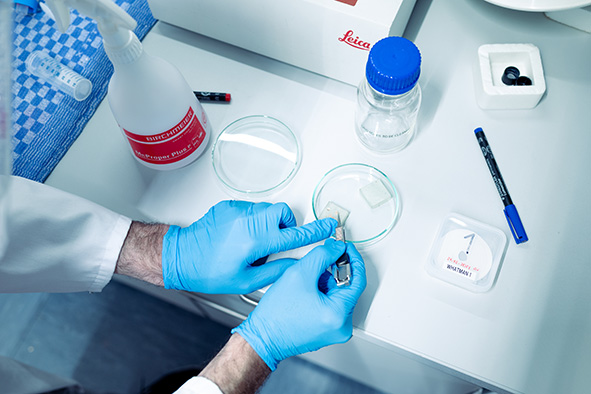
Foto: Verena Steinwider
Ist die Probe auf dem kleinen Gitter, wird dieses in das Gefriergerät „Plunge Freezer“ eingespannt und automatisch in flüssiges Ethan getaucht. Das flüssige Ethan hat etwa minus 180 Grad Celsius, um unsere Probe schockzufrieren. So bleibt die Struktur des Moleküls erhalten und wird nicht durch Eiskristalle deformiert, wie man es von daheim kennt, wenn man frisches Gemüse einfriert.

Unsere Probe wird bei minus 180 Grad Celsius schockgefroren.
Foto: Verena Steinwider
Auch während der Bildaufnahme im Mikroskop muss die Probe auf unter minus 140 Grad Celsius gekühlt bleiben. Bei den neuesten Kryo-Elektronenmikroskopen dürfen Menschen während der Aufnahme nicht mehr im selben Raum sein. Deshalb verließen wir den Raum, nachdem wir die Probe in das Elektronenmikroskop gegeben hatten. Die Monitore zur Steuerung des Mikroskops sowie zur Bildbearbeitung befinden sich in einem separaten Raum.

Das Elektronenmikroskop soll Aufnahmen mit einer Auflösung von 1 Ångström möglich machen.
Foto: Verena Steinwider
Und so sind wir zu den Fotos von Apoferritin gekommen, die ihr hier sehen könnt. Man erkennt die runde Form des Apoferritin. Mit längerer Aufnahmezeit und aufwendiger Bildbearbeitung mit eigenen Softwareprogrammen kann man 3D-Aufnahmen wie in dem schon vorher erwähnten Artikel in der Fachzeitschrift Nature machen.

Aufnahmen von Apoferritin. Das linke Foto wurde mit dem einfachen Elektronenmikroskop aufgenommen. Für die Probenaufbereitung verwendeten wir die Negativkontrastierung. Die runde Form von Apoferritin ist gut zu erkennen, doch meist sind die Konturen nicht scharf und auch der dunkle Hintergrund ist deutlich und störend. Das rechte Foto wurde mit einem neueren Kryo-Elektronenmikroskop aufgenommen. Wir bereiteten die Probe dafür mit dem „Plunge-Freezer“ vor. Die Konturen von Apoferritin sind deutlich klarer und der Hintergrund ist weniger störend.
© Thomas Heuser (VBC)
Wenn Menschen die Maschinen stören
Um eine gute Aufnahme des Apoferritin zu bekommen, mussten Thomas Heuser und ich den Raum verlassen. Warum das? Das liegt nicht daran, dass Apoferritin ein besonders scheues Protein ist und seine Privatsphäre braucht. Neuere Elektronenmikroskope sind so sensitiv, dass nicht nur Menschen im selben Raum den Elektronenstrahl stören, sondern auch der Lift, der zehn Meter entfernt auf und ab fährt, oder ein Auto in der Garage unter dem Gebäude. Sogar die Straßenbahn oder die Schnellbahn haben Auswirkungen auf den Elektronenstrahl. Wie kommt das?
Das hat etwas mit dem Erdmagnetfeld zu tun. Eigentlich mit den Veränderungen des magnetischen Feldes, welche das Elektronenmikroskop „spürt“. Wenn sich eine große metallische Masse in der Nähe bewegt, kann dies den Elektronenstrahl um Nanometer verschieben. Das Magnetfeld an sich bleibt aber immer konstant. Um solche Störungen zu vermeiden, wurde das neueste Elektronenmikroskop im Vienna BioCenter nicht nur von den Veränderungen des Magnetfeldes abgeschirmt, sondern fast komplett vom Magnetfeld an sich – mit einer Isolierung aus einem Eisen-Nickel-Gemisch. Zusätzlich ist der Raum gekühlt und entfeuchtet. Wenn Menschen während einer Aufnahme den Mikroskopierraum betreten, kann man das in der Aufnahme sehen. Nicht nur, weil sich durch das Aufmachen der Türe das Magnetfeld verändert, sondern auch durch die Wärme und Feuchtigkeit, die ein Mensch abgibt.
Sehen & Verstehen
Was lange Zeit als unüberwindbare Grenze galt, wurde nun überwunden: die Auflösung von 1 Ångström. Das ist eine große Sensation! Denn eine Auflösung von 1 Ångström bedeutet, einzelne Atome im Mikroskop sichtbar machen zu können. Doch die noch viel größere Sensation der neuesten Elektronenmikroskope und Probenaufbereitungen liegt im Sichtbarmachen von biologischen Prozessen. Bisher konnte man tote und isolierte Materie abbilden. Nun kann man einzelne Moleküle in ihrer natürlichen Umgebung abbilden und ihnen auch bei der Arbeit zusehen.
Man kann zum Beispiel sehen, wenn ein Molekül an ein anderes bindet. Das ist vor allem in der Medikamentenentwicklung von Bedeutung. Man kann sehen, wie ein Medikament an sein Ziel im Körper bindet und ob sich dieses Ziel dann verändert, ob es seine Umgebung verändert oder ob womöglich eine ganze Kaskade an Ereignissen im Körper in Gang gesetzt wird. So könnte man Wirkmechanismen von Medikamenten deutlich besser verstehen.
Man kann sehen, wie dicht gepackt die Zelle ist. Das ist ein großer Fortschritt für das Verständnis in der Biologie. Wahrscheinlich werden auch die Abbildungen von Zellen in Lehrbüchern an die neuesten Erkenntnisse angepasst.
Man wird endlich den molekularen Maschinen von Lebewesen beim Arbeiten in ihrer natürlichen Umgebung zusehen können. Etwa, wie vorhin erwähnt, die Ribosomen dabei beobachten, wie sie mRNA in Proteine umwandeln. Bisher weiß man zwar, wie Ribosomen funktionieren. Man konnte auch Modelle davon zeichnen. Aber nun kann man den Ablauf tatsächlich fotografieren.
Und all das kann man auch als 3D-Bilder darstellen. Mit neuester Hardware, verbesserter Probenaufbereitung und vor allem mit neuen Software- und Bildbearbeitungsprogrammen. Mithilfe von Algorithmen ist es möglich, Information von vielen tausenden von Bildern zusammenzufügen, um ein Bild mit möglichst viel Information, hoher Auflösung und als 3D-Modell zu erhalten. Die meiste Arbeit wird also künftig von einem Computer und dem Mikroskop erledigt.
Mithilfe von Künstlicher Intelligenz werden Muster erkennbar werden. Man wird also beispielsweise nach einem Molekül in der Zelle suchen können, das ein Hinweis auf Tumorbildung ist. Vielleicht können wir durch die Positionierung, die Häufigkeit oder die Form des Moleküls etwas über den Fortschritt der Krankheit lernen.
Viel von dem, was wir über Biologie auf molekularer Ebene zu wissen glauben, werden wir in den nächsten Jahren endlich sehen können – und unsere Annahmen, Messungen und Berechnungen überprüfen. Damit müssen wir uns nicht mehr nur auf gut begründete oder bewiesene Theorien von Wissenschaftler:innen verlassen, die manchmal schwer zu verstehen sind. Tatsächlich können wir einfach abbilden und zeigen, was im Körper passiert. So sieht das auch David Haselbach:
„Visualisierungen sind vor allem fürs Verständnis und die Kommunikation der wissenschaftlichen Erkenntnisse wichtig.“

.jpg)


.png)