Warum das wichtig ist: Nanobodies stellen aufgrund ihrer besonderen Eigenschaften ein interessantes Forschungsfeld dar. Haie und Lamas sowie weitere Arten der Kameltiere und Knorpelfische bilden diese besonderen Antikörper, die um ein Vielfaches kleiner sind als jene des Menschen. Die potentiellen Anwendungsbereiche sind breit gefächert, von Medikamenten bis zu bildgebenden Verfahren.
Druckfrisch gibt es die zweite alexandria-Ausgabe "Warum wir streiten" zu kaufen. Bestell bequem online und lies, warum Streit für eine Demokratie fundamental ist, wie Bakterien streiten und wie du in einer Beziehung streiten solltest. Außerdem: Ein Ausflug in die Präparationswerkstatt des Naturhistorischen Museum Wiens, Artikel über die ersten Sterne und strukturellen Rassismus, wie Bakterien dichten können und noch vieles mehr!
Bestelle hier und hol dir das schönste aller Wissenschaftsmagazin nach Hause!
Klein, aber großartig
Zu Beginn der 1990er-Jahre entdeckten belgische Forscher:innen in Dromedaren besondere Antikörper. Sie unterscheiden sich in ihrem Aufbau von konventionellen Antikörpern und sind um ein 10-faches kleiner. Neben Kamelarten bilden auch Knorpelfische, etwa Haie, diese sogenannten Einzeldomän-Antikörper. (Hamers-Casterman et al., 1993; Greenberg et al., 1995)
Aber wofür brauchen wir überhaupt Antikörper? Bei einer Infektion bildet das Immunsystem Antikörper gegen den betreffenden Erreger. Dieser Mechanismus hilft bei einer weiteren Infektion mit demselben Erreger, diesen schneller abzuwehren. Wie alle Proteine bestehen auch Antikörper aus Aminosäuren. Diese sind in Ketten angeordnet, wobei Antikörper aus je zwei „leichten“ und zwei „schweren“ Ketten in Y-Form bestehen.
Einzeldomän-Antikörper bestehen hingegen nur aus einer „schweren“ Kette. Die Fähigkeit, Teile von Erregern zu erkennen und zu binden, ist bei Einzeldomän-Antikörpern genauso vorhanden wie bei konventionellen Antikörpern. Diese erfolgt über die beiden „Arme“ der Y-Struktur, die sogenannte Antigen-Bindestelle. Je nach Antikörper variiert dieser Teil, weshalb er auch als variabler Teil bezeichnet wird.
Als Nanobody (Nb) wird der abgespaltene variable Teil von Einzeldomän-Antikörpern bezeichnet und stellt damit das kleinste natürlich vorkommende, Antigen-bindende Fragment dar.
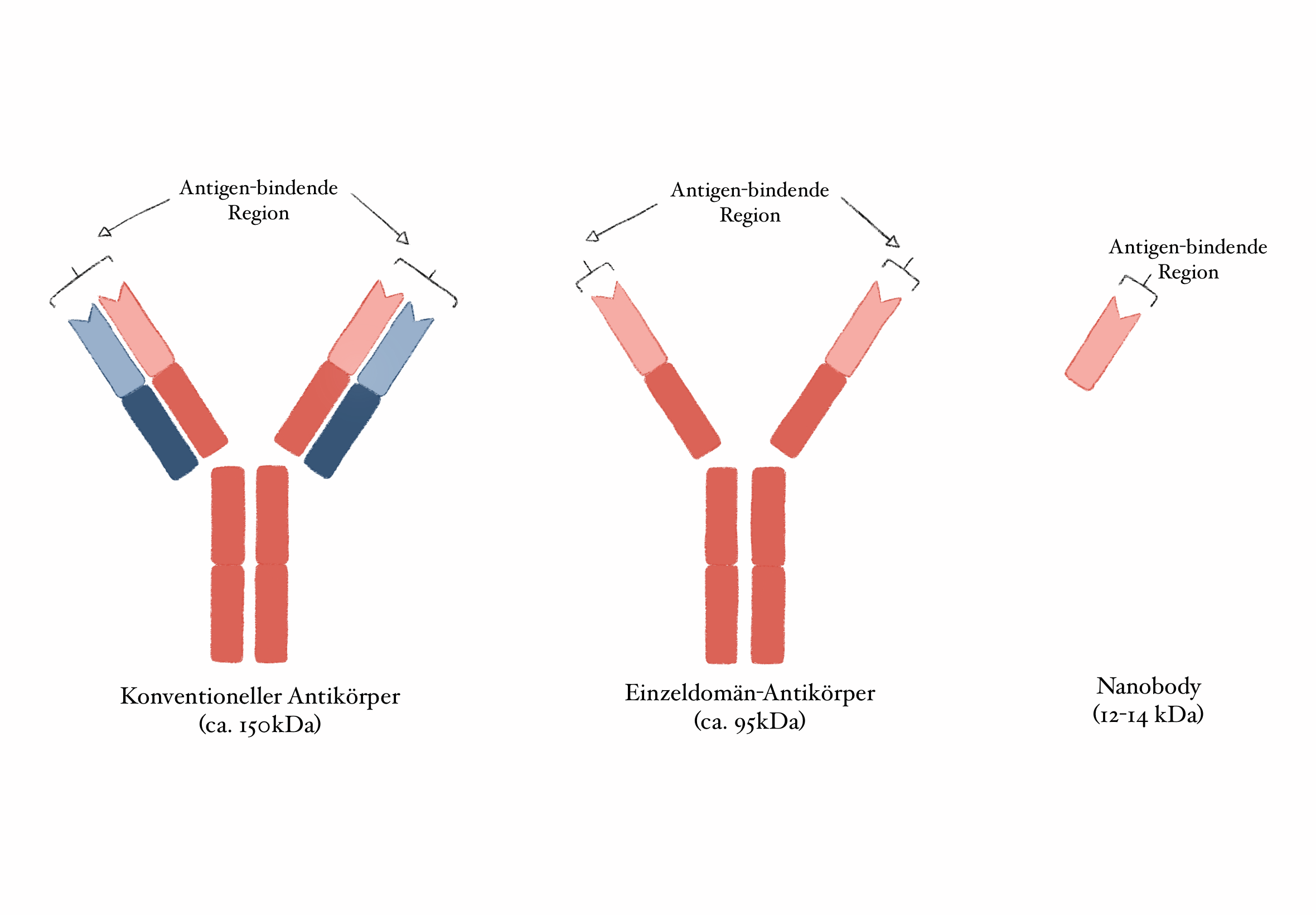
Abbildung 1: Unterschiedlicher Aufbau von konventionellem Antikörper, Einzeldomän-Antiköper und Nanobody (von links). Die "schweren" Aminosäureketten sind in Dunkelrot, die "leichten" in Blau dargestellt. Die variable, Antigen-bindende Region ist heller schattiert (Quelle: Victoria Lunz)
Nanobodies fehlt damit der „Fuß“ des Y, der konstante Teil eines Antikörpers, auch Fc-Domäne genannt. Dieser ist Spezies-spezifisch, variiert also beispielsweise von Mensch zu Maus. Bei der Anwendung von tierischen Antikörpern beim Menschen kann es zu Problemen kommen, da das Immunsystem diesen Teil als körperfremd erkennt und eine Abwehrreaktion auslöst.
Neben ihrer geringen Größe besitzen Einzeldomänen-Antiköper und Nanobodies (Nbs) noch weitere erstaunliche Eigenschaften. So sind sie um einiges stabiler als konventionelle Antikörper, sowohl gegen Hitze als auch gegen Säuren sind sie besser geschützt.
Auch in der Herstellung schlagen Nbs ihre größeren „Geschwister“, da sie einfach und ohne Veränderungen in größerer Menge gewonnen werden können. Bei Antikörpern besteht bei der Vervielfältigung in Bakterien immer die Gefahr von sogenannten posttranslationalen Modifikationen, die von den Bakterien bei der Produktion eingefügt werden. Diese rufen im Menschen das Immunsystem auf den Plan und können zu ungewollten Abwehrreaktionen führen, deshalb sind Nbs, bei denen keine solche Modifikationen vorkommen, für Menschen besser verträglich.
Durch die Immunisierung von Lamas, Kamelen oder Dromedaren können spezifische Nbs gewonnen werden. Dabei wird den Tieren jenes Protein, gegen das Antikörper gebildet werden sollen, verabreicht (im Falle von Covid-19 etwa das Spike-Protein) und nach einigen Wochen Blut abgenommen. Da eine natürliche Immunreaktion in den Tieren ausgelöst wurde, kann in weiterer Folge aus dem Blut der Bauplan für jene Nanobodies, die von Interesse sind, isoliert werden. Durch weitere Selektionsprozesse werden die am besten und genausten bindenden Nbs identifiziert und schließlich in Bakterien vervielfältigt (Jovecevska & Muyidermans, 2020).
Nanobodies als Hoffnungsträger
Für neue Darreichungsformen von Medikamenten ist auch die Größe der wichtigste Vorteil der Nanobodies (Nbs). Sie können zum Beispiel mit einem Inhalator aufgenommen werden. Dies stellt insbesondere bei Lungenerkrankungen einen weiteren Vorteil dar, da die Medikation so direkt an den Ort der Wirkung gelangt. In diesem Zusammenhang berichteten zwei Arbeitsgruppen der Universitäten in Pittsburgh und Texas in Zusammenarbeit mit Kollegen aus Gent im vergangenen Jahr auch von einer potentiellen Anwendung von Nbs für SARS-CoV-2 bzw. die davon ausgelöste Erkrankung Covid-19.
Amerikanische und belgische Forscher:innen berichteten in den Fachjournalen Cell und Science von der Immunisierung der Lamas „Winter“ und „Wally“ mit dem Spike-Protein des SARS-CoV-2-Virus, welches für das Eindringen des Virus in Zellen verantwortlich ist. Nach sechs Wochen konnten die Wissenschaftler:innen Nanobodies gegen das virale Protein isolieren. Schon in kleinsten Mengen schützen diese Nanobodies vor einer Infektion mit dem Virus, indem sie dieses neutralisieren (Wrapp et al., 2020; Xiang et al., 2020).
Auch eine australische Forschergruppe berichtete im April, dass eine Kombination zweier aus Alpakas isolierten Nbs das Eindringen des Virus in die Zellen verhindert. Die Australier heben auch die mögliche Anwendung dieser Nbs bei anderen humanen Beta-Coronaviren, wie SARS-CoV und MERS, hervor (Pymm et al., 2021).
Diese Eigenschaften von Nbs erscheinen vielversprechend im Kampf gegen das Coronavirus, müssen aber noch zahlreiche klinische Studien großen Ausmaßes durchlaufen, bevor Nanobodies bei der Behandlung von Patient:innen angewendet werden können.
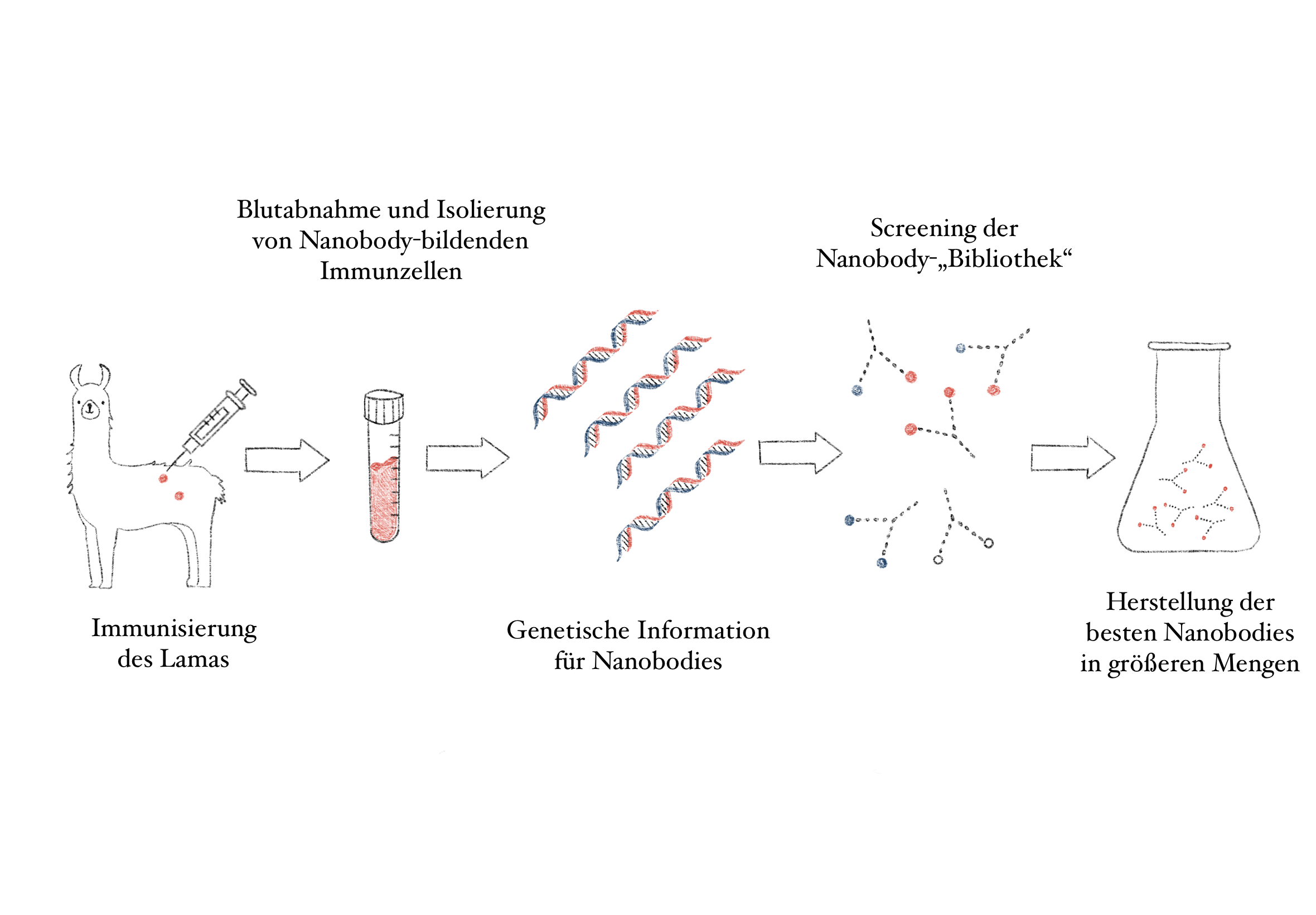
Abbildung 2: Schematische Darstellung zur Gewinnung von spezifischen Nanobodies (Quelle: Victoria Lunz)
Die kleine Konstitution der Nbs ist auch dort von Vorteil, wo Antikörper wegen ihrer Größe nicht hinkommen. In einer aktuellen Arbeit der Universität von Ohio zeigten die Forscher:innen im Mausmodell die Wirksamkeit von Nbs bei der durch Zecken übertragene humane monozytäre Ehrlichiose (HME). Diese Infektion wird vom Bakterium Ehrlichia chaffeensis ausgelöst und kommt vor allem in den USA häufig vor. 77 Prozent der Patient:innen müssen wegen hohem Fieber stationär aufgenommen werden und in weiterer Folge kann es zu akutem Nierenversagen oder Meningoenzephalitis kommen. Das Bakterium kapert Immunzellen und schaltet so die Abwehrmaschinerie aus. In der Studie, die im April im Fachjournal PNAS erschienen ist, zeigten Wissenschaftler:innen, dass mittels Nbs die Wege jenes Proteins blockiert werden können, das den Bakterien ermöglicht, Immunzellen zu kapern. (Zhang et al., 2021)
Wie auch die Anwendung gegen SARS-CoV-2, erfordert dieser Ansatz noch weitere Studien. Die Möglichkeit der Anwendung von Nbs als Medikament außerhalb von klinischen Studien zeigt die Zulassung eines Nanobody-Medikaments gegen Thrombotisch-thrombozytopenische Purpura (TTP), eine lebensbedrohliche Erkrankung, bei der Blutgerinnsel hervorgerufen werden, die zu Organschäden führen (Scully et al., 2019).
Aktuell laufen einige klinische Studien mit Nanobodies zur Behandlung von verschiedenen Krebsarten und Rheumatoider Arthritis.
Molekulare Bildgebung bisher unerreichbarer Stellen
Aber nicht nur als Medikation erweisen sich Nanobodies als vielversprechende Hoffnungsträger, auch bei diagnostischen Verfahren werden die winzigen Antikörper vermehrt eingesetzt. Molekulare Verfahren zur Bildgebung basieren auf der Markierung von Antikörpern mittels Fluorophoren oder Radioisotopen, die spezifisch an bestimmte Gewebe oder Biomarker binden. Auf diese Weise werden biologische Prozesse auf molekularer Ebene sichtbar gemacht und es können Veränderungen in diesen Vorgängen frühzeitig erkannt werden, noch bevor es zu Symptomen kommt.
Bei Tumorerkrankungen gibt es zahlreiche Proteine, deren Vorkommen stark erhöht ist. Diese können als Biomarker fungieren, da sie im Vergleich zu gesunden Menschen in größerer Menge vorliegen und ab bestimmten Grenzen ein Indiz für eine Krebserkrankung sind.
Nanobodies kommen hier vermehrt zum Einsatz, da ihre Erbinformation auf einem einzigen Gen kodiert ist und so die Verknüpfung mit anderen Molekülen einfacher ist als bei anderen Antikörpern. Die möglichen Kombinationen reichen von Nbs gekoppelt an Fluorophore, Radioisotope oder andere fotodynamische Substanzen bis hin zu verschiedenen Nbs aneinander. (Steeland et al, 2016)
Wenn an einen relativ großen Antikörper auch noch ein anderes Molekül gehängt wird, wird dieser langsamer und vor allem zu groß, um in viele Gewebe einzudringen und so alle möglichen Stellen für das Vorkommen spezifischer Proteine zu erreichen. Dieses Problem haben Nbs nicht: Da sie selbst so klein sind, stört auch ein gekoppeltes Signalmolekül die Beweglichkeit nicht. Sie zirkulieren im Blut schnell durch den ganzen Körper und können gut in Gewebe eindringen, die für die größeren Antikörper unerreichbar bleiben.
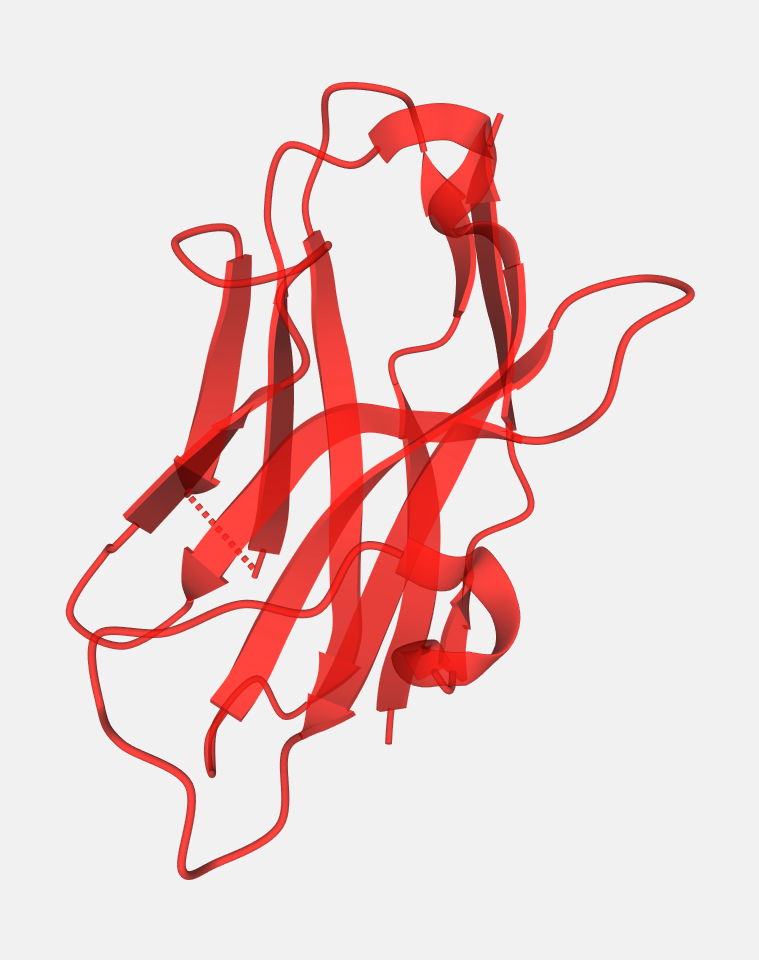
Abbildung 3: Klein, aber oho: Nanobodies. Sie können nicht nur dabei helfen, Krankheiten zu bekämpfen, sondern auch, sie überhaupt erst zu entdecken. (Quelle: Protein Data Bank)
Ein weiterer Vorteil von Nbs in der Bildgebung ist der geringere unspezifische Hintergrund, also die Störung durch ein falsches Signal von „herumschwimmenden“ Nbs. Dies ist der schnellen Ausscheidung der Nbs geschuldet. Diese kurze Verweildauer ist ein ganz besonderer Vorteil in Bezug auf radioaktive Substanzen, die beispielsweide bei positron-transmissions Tomographie (PET)-Verfahren verwendet werden. Dabei werden Schnittbilder gemacht, die die Verteilung von radioaktiv markierten Molekülen im Organismus zeigen und mit ihnen deren molekulare Funktion. Durch die relativ schnelle Ausscheidung der Nbs und somit auch des radioaktiven Stoffes, bleibt dieser nicht länger als nötig im Körper (Schoonooghe et al., 2012).
Mit der schnellen Ausscheidung über die Nieren gehen allerdings zwei Nachteile der Nbs einher. Einerseits ist die Verweildauer im Körper für manche Anwendungen zu kurz. Durch die Kopplung an andere Proteine wie beispielsweise Albumin kann die Verweildauer jedoch verlängert werden. Andererseits kann es in den Nieren zu einer Ansammlung der markierten Nbs kommen. Da dies zu einer Schädigung der Niere führen kann, gibt es bereits Strategien, dies zu verhindern (Debie et al., 2019).
In weiteren Entwicklungen können markierte Nbs nicht nur in der Diagnostik angewendet werden, sondern auch für molekulare Therapien, wie beispielsweise die photodynamische Therapie (PDT). Dabei wird ein photo-aktivierbares Molekül gekoppelt an einen Nb zum Zielgewebe transportiert. Durch die Bestrahlung mit Licht der richtigen Wellenlänge wird schließlich das therapeutische Molekül aktiviert (Debie et al., 2019).
Bei Krebserkrankungen erfolgt die Bindung an bekannte tumorspezifische Proteine, beispielsweise an den humane epidermale Wachstumsfaktor 2 (human epidermal growth factor - HER2). Dieses Protein ist bei 15 bis 50 Prozent der Brustkrebserkrankungen sehr stark erhöht. Eine Gruppe belgischer Forscher:innen koppelte in einer Studie aus dem Jahr 2011 einen gegen HER2 gerichteten Nb (anti-HER2) an kleinste Goldpartikel. Durch Anregung mit einem Laser entwickelten diese Partikel so viel Wärme, dass die Tumorzellen zerstört wurden. Dieser Ansatz stellt somit eine neue mögliche Krebstherapie dar (Van de Broek et al., 2011).
Nanobodies sind vielseitig einsetzbare Antikörper, von denen in den nächsten Jahren bestimmt noch oft die Rede sein wird. Die Kleinsten haben gute Chancen, ganz groß rauszukommen.
Victoria Lunz hat an den Universitäten Salzburg und Linz Molekularbiologie studiert und promovierte 2019 an der Johannes-Kepler-Universität Linz. Schon während ihres Studiums kam sie im Zuge einer Seminararbeit in Berührung mit Nanobodies. Seither ist sie fasziniert von deren vielfältigen Einsatzmöglichkeiten und möchte dieses Thema wie auch viele andere für die Allgemeinheit aufbereiten.
Auf LinkedIn ist sie hier zu finden.
- Ein Video des Science Magazine erklärt, was Nanobodies alles können (englisch): Mini-antibodies discovered in sharks and camels could lead to drugs for cancer and other diseases (Science)
- Eine ganze Vorlesung über den Einsatz von Nanobodies zur passiven Immunisierung gegen Covid-19 (englisch): Aerosolized Nanobodies for Sars-Cov-2-Passive Immunization (University of California)
Debie, P., Devoogdt, N., Hernot, S. (2019) Targeted Nanobody-Based Molecular Tracers for Nuclear Imaging and Image-Guided Surgery.
Antibodies. https://doi.org/10.3390/antib8010012
Greenberg, A.S., Avila, D., Hughes, M., Hughes, A., McKinney, E.C., Flajnik, M.F. (1995). A new antigen receptor gene family that
undergoes rearrangement and extensive somatic diversification in sharks. Nature, 374(6518). 168-73. doi: 10.1038/374168a0
Hamers-Casterman, C., Atarhouch, T., Muyldermans, S., Robinson, G., Hammers, C., Bajyana Songa, E., Bendahman, N., Hammers, R.
(1993). Naturally occurring antibodies devoid of light chains. Nature, 363, 446–448. https://doi.org/10.1038/363446a0
Jovčevska, I., Muyldermans, S. (2019). The Therapeutic Potential of Nanobodies. BioDrugs. doi: 10.1007/s40259-019-00392-z
Oliveira, S., Heukers, R., Sornkom, J., Kok, R.K., van Bergen en Henegouwen, P.M.P. (2013). Targeting tumors with nanobodies for cancer
imaging and therapy. Journal of Controlled Release, 172(3), 607-617. https://doi.org/10.1016/j.jconrel.2013.08.298
Pymm, P., Adair, A., Chan, L.J., Cooney, J.P., Mordant, F.L., Allison, C.C., Lopez, E., Haycroft, E.R., O’Neill, M.T., Tan, L.L., Dietrich,
M.H., Drew, D., Doerflinger, M., Dengler, M.A., Scott, N.E., Wheatley, A.K., Gherardin, N.A., Venugopal, H., Cromer, D., Davenport,
M.P., Pickering, R., Godfrey, D.I., Purcell, D.F.J., Kent, S.J., Chung, A.W., Subbarao, K., Pellegrini, M., Glukhova, A., Tham, W.H.
(2021). Nanobody cocktails potently neutralize SARS-CoV-2 D614G N501Y variant and protect mice. Proceedings of the National
Academy of Sciences, 118(19): https://doi.org/10.1073/pnas.2101918118
Schoonooghe, S., Laoui, D., Van Ginderachter, J.A., Devoogdt, N., Lahoutte, T., De Baetselier, P., Raes, G. (2012). Novel applications of
nanobodies for in vivo bio-imaging of inflamed tissues in inflammatory diseases and cancer. Immunobiology, 217(12), 1266-1272.
https://doi.org/10.1016/j.imbio.2012.07.009
Scully, M., Cataland, S.R., Peyvandi, F., Coppo, P., Knöbl, P., Kremer Hovinga, J.A., Metjian, A., de la Rubia, J., Pavenski, K., Callewaert,
F., Biswas, D., De Winter, H., Zeldin, R.K.; for the HERCULES Investigators (2019). Caplacizumab Treatment for Acquired
Thrombotic Thrombocytopenic Purpura. The New England Journal of Medicine, 380(4), 335-346.
Steeland, S., Vandenbroucke, R.E., Libert, C., (2016). Nanobodies as therapeutics: big opportunities for small antibodies. Drug Discovery
Today, 21(7), 1076-1113. https://doi.org/10.1016/j.drudis.2016.04.003
Van de Broek, B., Devoogdt, N., D’Hollander, A., Gijs, H.L., Jans, K., Lagae, L., Muyldermans, S., Maes, G., Borghs, G. (2011). Specific
Cell Targeting with Nanobody Conjugated Branched Gold Nanoparticles for Photothermal Therapy. ACS Nano.
Wrapp, D., De Vlieger, D., Corbett, K.S., Torres, G.M., Wang, N., Breedam, W., Roose, K., Van Schie, L., VIB-CMB COVID-19 Response
Team, Hoffmann, M., Pöhlmann, S., Graham, B.S., Callewaert, N., Schepens, B., Saelens, X., McLellan, J.S. (2020). Structural Basis for
Potent Neutralization of Betacoronaviruses by Single-domain Camelid Antibodies. Cell. https://doi.org/10.1016/j.cell.2020.04.031
Xiang, Y., Nambulli, S., Xiao, Z., Liu, H., Sang, Z., Duprex, W.P., Schneidman-Duhovny, D., Zhang, C., Shi, Y. (2020). Versatile and
multivalent nanobodies efficiently neutralize SARS-CoV-2. Science. https://doi.org/10.1126/science.abe4747
Zhang, W., Lin, M., Yan, Q., Budachetri, K., Hou, L., Sahni, A., Liu, H., Han, N.C., Lakritz, J., Pei, D., Rikihisa, Y. (2021). An intracellular
nanobody targeting T4SS effector inhibits Ehrlichia infection. Proceedings of the National Academy of Sciences, 118(18), e2024102118.
https://doi.org/10.1073/pnas.2024102118

.jpg)


.png)