Dieser Artikel erschien innerhalb unseres Themenschwerpunkts "Warum wir streiten". Wenn du mehr darüber erfahren möchtest, wo Streit überall stattfindet und auf welche Arten wir streiten, hol dir die zweite Ausgabe hier.
Warum wir streiten: Vergleicht man das immunologische Geschehen in unserem Körper mit einem Schlachtfeld, stellen Krankheitserreger Invasoren dar, deren Ziel es ist, fremdes Terrain für sich zu gewinnen. Bei diesem immerwährenden Streit kämpfen beide Seiten um ihr Überleben. Die Eindringlinge versuchen, Ressourcen unseres Körpers sowie neue Lebensräume für sich zu erschließen, um die Existenz ihrer Spezies zu sichern. Dabei müssen sie physische Barrieren durchdringen und die aktive Verteidigung diverser Immunzellen umgehen. Diesen Kampf führen wir ununterbrochen - und oft unbemerkt – jede Sekunde, unser ganzes Leben lang.
Das Verteidigungssystem
Als Immunantwort bezeichnet man jede Reaktion des Körpers gegen eine Substanz oder einen Organismus, der vom Körper als „fremd“ und potenziell gefährlich eingestuft wird.
Die Verteidigung gegen Eindringlinge oder Schadstoffe ist sehr aufwändig. Um eine Verschwendung von Ressourcen zu vermeiden, ist unsere Immunantwort in mehreren Etappen aufgebaut. Dies ermöglicht es, abgestimmt auf den Grad der jeweiligen Bedrohung zu reagieren.

Abbildung 1: Wie ein Graben voller Wasser oder die Wachen auf den Türmen im Mittelalter eine Burg beschützten, wehrt auch unser Immunsystem Eindringlinge ab.
Die verschiedenen Stufen der Verteidigung des Immunsystems kann man mit den Abwehrmechanismen einer mittelalterlichen Burg vergleichen. Physische Barrieren wie ein Burggraben und hohe Mauern sowie Wachen am Tor sorgen für einen guten Schutz, der in den meisten Fällen ausreichend ist. Als biologisches Gegenstück besitzen wir unser sogenanntes angeborenes Immunsystem.
Die äußeren Gewebsschichten grenzen den Körper wie ein Burggraben und Schutzmauern klar von der Außenwelt ab. Zu ihnen gehört unsere Haut, aber auch unser Darmepithel und andere Schleimhäute. Sie sind der erste Berührungspunkt mit Pathogenen, den potenziellen Erregern von Krankheiten, und stellen daher einen essenziellen Teil der angeborenen Immunität dar. Sollte diese physikalische Barriere dennoch überwunden werden, schlägt das angeborene Immunsystem Alarm.
Sowohl Hautzellen als auch Immunzellen der angeborenen Immunantwort besitzen Mustererkennungsrezeptoren. Diese Rezeptoren erkennen fremde Strukturen, so genannte Pathogen-assoziierte molekulare Muster (PAMM), die viele Pathogene gemeinsam haben. Vergleichen kann man diese Fähigkeit mit Wachposten einer Burg, die Eindringlinge sofort ausmachen, festnehmen und melden. Erkennt das Immunsystem diese PAMMs, wird eine rasche Immunantwort eingeleitet, indem Botenstoffe umliegende Zellen über die Anwesenheit von Eindringlingen informieren. Nun kommen die sogenannten Fresszellen ins Spiel: Pathogene, die PAMMs aufweisen, werden von jenen Fresszellen des Immunsystems erkannt und sofort aufgefressen - somit erfolgt die rasche Eliminierung der Erreger. Wir bemerken davon in den meisten Fällen nur eine Rötung und Schwellung wie z.B. bei einem Kratzer.
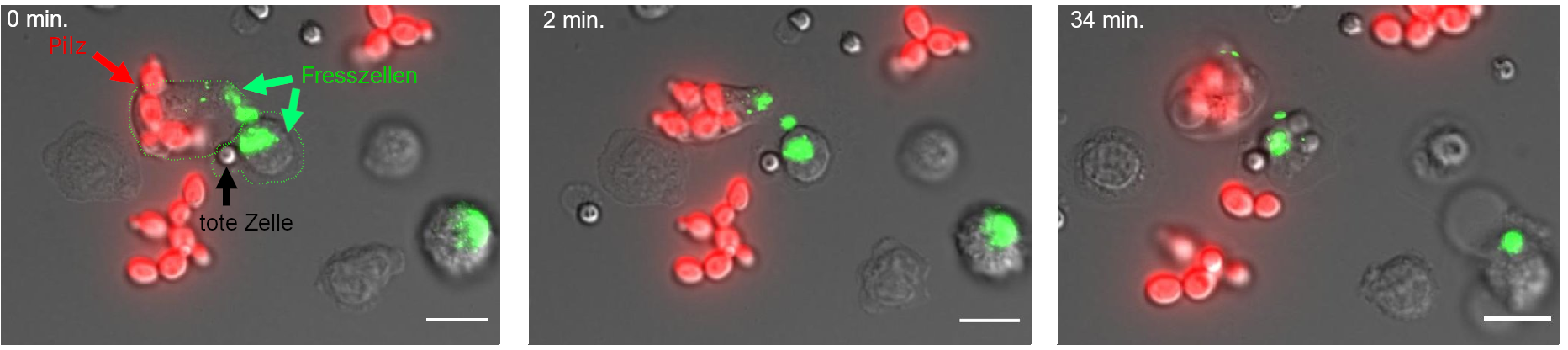
Abbildung 2: Fresszellen bei der Arbeit: Ausschnitte aus einer mikroskopischen Zeitrafferaufnahme.
Die Fresszellen erscheinen grau, und leicht transparent. Teile der Oberfläche von Fresszellen sind mit einem grünen Farbstoff markiert. Die Pilzzellen sind an der roten Färbung erkennbar.
0 min (linkes Bild): zwei zentrale Fresszellen (grüne Pfeile, grüne Umrandung) interagieren mit Pilzzellen (roter Pfeil).
2 min (mittleres Bild): die Fresszellen fangen an die Pilzzellen aufzunehmen.
34 min (rechtes Bild): die Pilze wurden erfolgreich aufgenommen.
Credits: Sabrina Jenull, Irina Tsymala
Die erworbene Immunantwort - Erweiterung des angeborenen Immunsystems
Was passiert aber, wenn diese Antwort nicht ausreicht? Sollte das angeborene Immunsystem nicht in der Lage sein, die Erreger restlos zu eliminieren, wird Verstärkung angefordert. Haben Feinde die Wachposten überlistet und sind in die Burg eingedrungen, reichen die Abwehrmechanismen des angeborenen Immunsystems meist nicht mehr aus. Es müssen spezifisch ausgebildete Kämpfer angefordert werden, um eine Invasion der Burg abzuwenden. Das sogenannte erworbene Immunsystem übernimmt diese spezifische Pathogenabwehr in unserem Körper. Es richtet sich gezielt gegen Eindringlinge, die es geschafft haben, sowohl die physischen Barrieren als auch die Immunzellen des angeborenen Immunsystems zu überlisten und dadurch eine große Gefahr für den gesamten Organismus darstellen. Die wichtigsten Zellen der erworbenen Immunantwort sind Lymphozyten. Diese spezialisierten Zellen müssen jedoch erst über den kritischen Zustand informiert werden. Hierfür erfüllt das angeborene Immunsystem seine zweite wichtige Aufgabe: die Rekrutierung und Aktivierung der erworbenen Immunabwehr.
Dazu können Fresszellen des angeborenen Immunsystems Teile von Pathogenen aufnehmen, zerkleinern und sie dann den Zellen des erworbenen Immunsystems als sogenannte Antigene präsentieren. Eine solche erworbene Immunantwort richtet sich dann spezifisch gegen den Erreger, von dem das Antigen stammt.
Stratgien des erworbenen Immunsystems
Je nach Beschaffenheit des Angreifers muss die beste Taktik zur Verteidigung gewählt werden, denn es gilt keine Zeit zu verlieren. Es gibt daher zwei Strategien erworbener Immunität, die von zwei unterschiedlichen Lymphozyten-Typen gesteuert werden. Sogenannte B-Lymphozyten produzieren Antikörper und entlassen diese ins Gewebe oder den Blutkreislauf. Solche zirkulierenden Antikörper können spezifisch Antigene (z.B. das Spike-Protein von SARS-CoV-2) erkennen, daran binden und Pathogene somit unschädlich oder für die Fresszellen erkennbar machen. Manche Erreger, darunter auch Viren, vermehren sich im Zellinneren. Antikörper können jedoch nicht in die Zelle eindringen, um das Antigen zu markieren. Deshalb gibt es, parallel zur Sekretion von Antikörpern, auch eine Zell-basierte Immunantwort. Bei dieser können spezialisierte T-Lymphozyten infizierte Zellen direkt eliminieren. Dabei regen T-Lymphozyten auch Fresszellen dazu an, ihrer Aufgabe nachzukommen. Unsere Lymphozyten haben aber auch noch eine weitere wichtige Fähigkeit: Nachdem der Erreger erfolgreich eliminiert wurde, können sich Lymphozyten des erworbenen Immunsystems zu den sogenannten Gedächtniszellen entwickeln. Diese merken sich das Antigen, um schneller und besser auf eine neuerliche Infektion mit demselben Antigen reagieren zu können. Diese Erinnerungsfunktion wird immunologisches Gedächtnis genannt und auch bei einer Impfung ausgenutzt, um den Körper vor einer gefährlichen (Zweit-)Infektion zu schützen. Die Immunantwort gegen ein auf diese Weise „registriertes“ Pathogen verläuft meist so effizient, dass wir sie kaum bemerken. Dadurch werden wir „immun“ gegen bestimmte Krankheitserreger (Abbas, Lichtman, & Pillai, 2017).
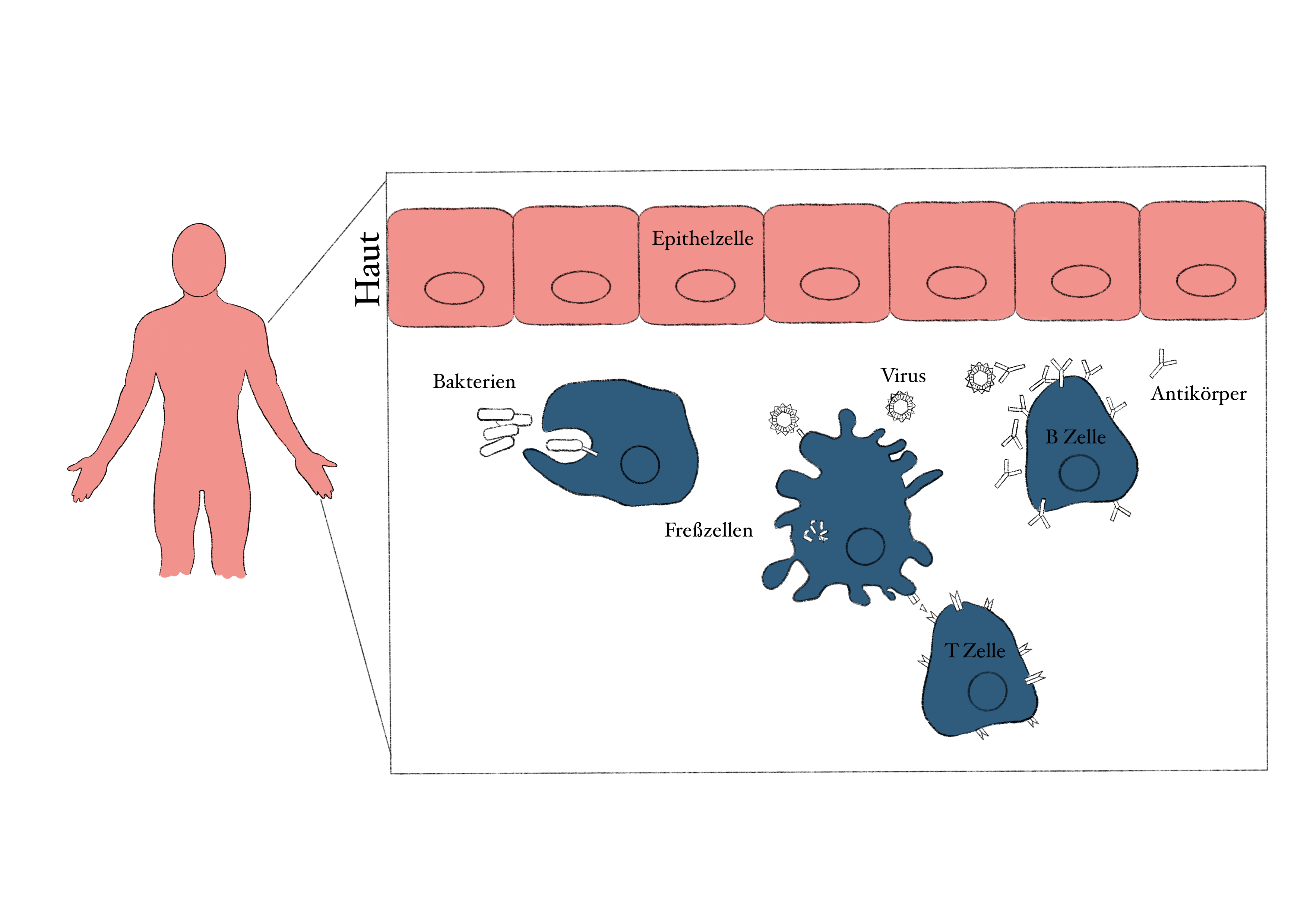
Abbildung 3: Die oberste Zellschicht unserer Haut und unserer Schleimhäute besteht aus so genannten Epithelzellen. Diese Zellen liegen sehr eng aneinander, sodass sie das Eindringen von Bakterien, Viren und anderen Erregern verhindern. Trotzdem schaffen es manche Pathogene, diese Barriere zu brechen und in unserem Körper einzudringen. Diese werden aber sofort von unseren Freßzellen erkannt, aufgenommen und eliminiert. Zusätzlich werden durch die Freßzellen auch B- und T-Zellen aktiviert. B-Zellen können Antikörper gegen den Erreger produzieren und T-Zellen können direkt infizierte Zellen eliminieren. Credits: Ramona Rica
Warum wir trotzdem krank werden: Das Erfolgsgeheimnis der Viren
Wie Pathogene versuchen in uns einzudringen, hängt stark davon ab, ob sie sich innerhalb oder außerhalb von Zellen vermehren. Bakterien und Pilze können beides, Viren hingegen brauchen die menschliche Zelle, um sich zu reproduzieren und sind daher strikt intrazellulär. Doch wie genau gelangen Viren eigentlich in unseren Körper?
Viren haben im Laufe der Evolution ausgeklügelte Methoden entwickelt, um in menschliche Zellen einzudringen. Das dahinterliegende Prinzip ist dabei immer gleich: Die Eindringlinge missbrauchen verschiedenste Oberflächenstrukturen, die unsere Zellen eigentlich zum Kommunizieren nutzen, um sich unbemerkt einzuschleusen. Welche Zelloberflächenstrukturen das Virus genau bindet, hängt davon ab, welche komplementären Oberflächenproteine es auf seiner eigenen Hülle besitzt. Das Spike-Protein von SARS-CoV2 ermöglicht es dem Virus in unsere Lungenepithelzellen zu gelangen. Weil aber nicht jeder Zelltyp mit den gleichen Oberflächenstrukturen ausgestattet ist, kann das Virus nur an bestimmte Zellen binden. Durch diese spezifische Interaktion ist jedes Virus auf einige wenige Zelltypen limitiert. So erklärt sich, warum ein Schnupfenvirus niemals AIDS auslösen kann, wie es zum Beispiel HI-Viren machen, oder umgekehrt.
Gelangt das Virus in die Zelle, übernimmt es diese komplett, so wie Invasoren eine eroberte Burg. Das Virus bringt die Zelle dazu mehr Viruspartikel herzustellen. Es missbraucht alle Ressourcen und Arbeitsprozesse der infizierten Zelle, um sich selbst zu vermehren. Dadurch kann die Zelle ihre eigentliche Aufgabe (im Fall vom Lungenepithel: atmen) nicht mehr ausüben. Hier entsteht ein mikroskopischer Streit darüber, wer nun die Oberhand über die Funktionen der Zelle gewinnt.
Ist die Zelle infiziert, versucht sie selbst das Virus zu bekämpfen und sendet gleichzeitig Botenstoffe aus, um umliegende Zellen zu warnen und das Immunsystem zu alarmieren. Eine der wichtigsten Klassen von Botenstoffe bei einer Virusinfektion sind Interferone (IFN). Eine menschliche Zelle sendet IFN aus, um zu signalisieren, dass sie von einem Virus infiziert wurde. Benachbarte Zellen im Gewebe erkennen dies und bereiten ein eigenes „anti-virales“ Programm vor, dass es dem Virus erschwert einzudringen (Ivashkiv & Donlin, 2014). Zusätzlich kann die besetzte Zelle als „Hilferuf“ kleine Teile des Virus auf ihrer eigenen Oberfläche so verpacken, dass Fresszellen auf sie aufmerksam werden und somit eine Immunantwort auslösen.
Das zugrundeliegende Infektionsprinzip bringt aber einen gewaltigen Nachteil für Viren mit sich: Werden sie vom Immunsystem erkannt und bekämpft, können sie, im Gegensatz zu extrazellulären Pathogenen, nicht fliehen und sind somit unserer Immunantwort ausgeliefert. Um sich davor zu schützen, haben Viren Wege gefunden unser Immunsystem auszutricksen. Zum Beispiel zwingen Viren wie SARS-CoV2 die infizierte Zelle Moleküle zu erzeugen, die die wichtigen Botenstoffe IFN unwirksam machen (Taefehshokr et al., 2020; Whitley, 2011). Zusätzlich können Viren Mustererkennungsrezeptoren abschirmen, um sich vor dem Immunsystem zu verstecken und einem Konflikt aus dem Weg zu gehen.
Kompromisse und Mutualismus
Eine weitere wichtige Aufgabe des Immunsystems ist es, Toleranz aufzubauen. Das ist lebensnotwendig und erlaubt unserem Körper das Streiten auch mal sein zu lassen. Der Mensch ist ein Biotop für zahlreiche Mikroorganismen. Neuesten Berechnungen zufolge besteht der menschliche Körper aus 3.8×10¹³ Zellen, beherbergt jedoch zugleich 10¹⁴ bis 10¹⁵ Bakterien und ein Vielfaches an Viren (Sender et al., 2016), die man zusammengefasst als das menschliche Mikrobiom bezeichnet. Viele Mikroorganismen, darunter unsere Darmbakterien, sind wichtiger Bestandteil dieses Ökosystems „Mensch“ und tragen zu unserer Gesundheit bei, andere wiederum machen uns krank. Unser Immunsystem hat dabei die komplexe Aufgabe, eine Balance aufrecht zu erhalten, die sowohl unser als auch das Überleben des gesamten Ökosystems bestimmt. Unser Mikrobiom hilft uns, Nahrung zu verdauen, und sichert somit die Versorgung unseres Körpers mit notwendigen Nährstoffen. Zusätzlich schützt es uns vor anderen Eindringlingen, die, wie bereits erwähnt, die Barrieren unseres Körpers zu überwinden versuchen. Gäbe es dieses Mikrobiom nicht, das neben dem Verdauungstrakt auch andere Oberflächen wie zum Beispiel die Haut besiedelt, müsste unser Immunsystem noch viel mehr Kraft aufwenden, um mögliche Krankheitserreger abzuwehren. Das Mikrobiom und dessen Einfluss auf unsere Gesundheit ist Gegenstand intensiver Forschung, denn nur wenig ist nach heutigem Stand der Wissenschaft darüber bekannt. Man geht davon aus, dass ein Ungleichgewicht des Mikrobioms an einer Vielzahl von Erkrankungen, wie zum Beispiel der chronisch-entzündlichen Darmerkrankung, Colitis Ulcerosa, beteiligt sein kann. Das Mikrobiom ist somit auch verantwortlich dafür, unser Immunsystem zu schulen: aufzuzeigen, wenn Erreger die Überhand gewinnen und gleichzeitig zu beruhigen, wenn es übertrieben wäre, alle Register einer Immunantwort zu ziehen.
Abbildung 4: Manchmal ist es für den Menschen auch besser, wenn unser Immunsystem nicht (sofort) zuschlägt.
Freund und Feind
Unser Immunsystem bewahrt uns davor, dass sich Pathogene in unserem Körper verbreiten und so lebenswichtige Funktionen beeinträchtigen. Trotz des immerwährenden Kampfes, den unser Immunsystem täglich auf sich nimmt, ist es wichtig zu verstehen, dass nicht jedes Bakterium gefährlich und nicht jedes Virus Todfeind unseres Organismus ist. Wesentlich mehr Mikroorganismen helfen unserem Körper oder besiedeln ihn, ohne uns dabei zu schaden. Der menschliche Körper beherbergt um ein Vielfaches mehr an Viren, Bakterien und Pilze als eigene Körperzellen. Die Aufgabe des Immunsystems ist es also, die Balance zwischen vehementer Bekämpfung von Pathogenen und Toleranz gegenüber hilfreichen Mikroorganismen zu finden und somit das Biotop „Mensch” ganzheitlich gesund zu halten.
Lena Artner arbeitet am Institut für Krebsforschung der Medizinischen Universität Wien.
Philipp Penninger und Irina Tsymala forschen in den Max Perutz Labs der Universität Wien und der Medizinischen Universität Wien.
Ramona Rica und Valentina Stolz arbeiten am Insitut für Immunologie der Medizinischen Universität Wien.
* Alle der hier genannten Wissenschaftler:innen haben gleichermaßen zu diesem Artikel beigetragen. Die Reihung der Namen folgt keinem Leistungsprinzip.
- Kurzgesagt erklärt in einem zweiteiligen Video das Komplementsystem, einen wichtigen Teil des Immunsystems: Kleine Bomben im Blut (Kurzgesagt, Youtube)
- Die Frage, die wir uns alle beim Lesen dieses Artikels gestellt haben: Wie können wir unser Immunsystem tatsächlich stärken? (netdoktor)
- Faktencheck: Schadet das Impfen eigentlich unserem Immunsystem? (Odysso - Wissen im SWR, YouTube)
Abbas, A., Lichtman, A., & Pillai, S. (2017). Cellular and Molecular Immunology (9th ed.). Elsevier.
Chaplin, D. D. (2010). Overview of the immune response. The Journal of Allergy and Clinical Immunology, 125(2), 3–S23.
https://doi.org/10.1016/j.jaci.2009.12.980
Ivashkiv, L. B., & Donlin, L. T. (2014). Regulation of type I interferon responses. Nature Reviews. Immunology, 14(1), 36–49.
https://doi.org/10.1038/nri3581
Sender, R., Fuchs, S., & Milo, R. (2016). Revised Estimates for the Number of Human and Bacteria Cells in the Body. PLoS Biology, 14(8),
1–14. https://doi.org/10.1371/journal.pbio.1002533
Taefehshokr, N., Taefehshokr, S., Hemmat, N., & Heit, B. (2020). Covid-19: Perspectives on Innate Immune Evasion. Frontiers in
Immunology, 11(September), 1–12. https://doi.org/10.3389/fimmu.2020.580641
Whitley, R. J. (2011). Herpes Simplex Virus Infections. Goldman’s Cecil Medicine: Twenty Fourth Edition, 2, 2125–2128.
https://doi.org/10.1016/B978-1-4377-1604-7.00382-1

.jpg)



.png)